合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
分子表面包裝對于磷脂單分子層膜中的錨定蛋白中酶活性的調制作用的影響——結果和討論
來源:上海謂載 瀏覽 825 次 發布時間:2021-12-01
結果和討論
表面壓縮性和酶活性。 純DMPA和混合DSAP/DMPA單層的表面壓力分子面積等溫線如圖1所示,與先前的結果一致。20,40對于純DMPA單層,每個分子在55和44?2之間存在一個典型的平臺,對應于液體膨脹(LE)和液體冷凝(LC)相的共存區, 而LE-LC轉變發生在8.0mn/m。 與此相反,DSAP/DMPA混合單分子膜不存在共存區,液相膨脹相保持,直到表面壓力達到20 mN/m以下。
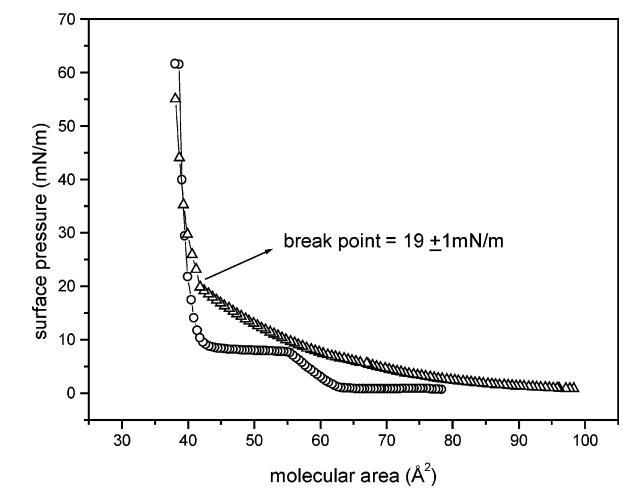
圖1.朗繆爾單分子膜的表面壓力-面積曲線:純DMPA(O)和DSAP/DMPA(1:3500,mol:mol)(4)。 曲線中顯示的斷點與混合單層的LE-LC轉變有關。
值得注意的是,為了避免不可逆的酶聚集,蛋白質被分散在預成型的DMPA單分子膜上,而不是注入亞相。 此外,溶解酶儲備溶液中的C12(EO)9 0.01%在擴散后進一步稀釋,這無疑有利于酶在界面上的位置,我們可以將此過程確定為“無表面活性劑酶的表面滲透”。 這一過程是實驗條件的結果,因為在亞相中將表面活性劑稀釋至10-6%(或0.21μmol/L)會使系統進一步低于堿性磷酸酶/C12(EO)9(3.6μmol/L20,22)混合系統的臨界聚集濃度(CAC)42。 事實上,表面活性劑的稀釋已被用作誘導GPI錨定蛋白質分子層吸附的成功方法。22,27此外,先前的數據20,22表明,向體積濃度為0.21μM的純水中添加C12(EO)9不會引起表面張力的變化, 既不適用于清潔空氣/水界面,也不適用于DMPA單層。
與酶表面沉淀過程相關的疏水性錨定物的存在強烈表明,酶的總擴散量應保持在與磷脂形成混合單層的空氣/液體界面,而底物(PNPP)及其水解產物(對硝基苯酚和無機磷酸鹽) 應保持在子階段。 這與一些關于脂肪酶催化活性的報告43-48大不相同。 在這些研究中,酶被注射到亞相,在吸附到界面后,它會對該界面上的脂質進行化學修飾。 相比之下,在目前的研究中,脂質單層充當酶的基質,并且在化學上不受影響。 此外,在對照實驗中未觀察到PNPP水解:在側隔室中未檢測到吸光度或活性,這意味著酶在亞相中未溶解。 另一方面,在存在混合單層的中央腔室中檢測到催化活性。 這一結果明確地表明,在所采用的實驗條件下,酶沒有分散在亞相中,而是完全吸附在氣液界面上。 還估計了在無酶的情況下PNPP的自發水解,考慮到實驗所用的時間間隔,可以忽略。
在5到18 mN/m的表面壓力下,DMPA的表面密度從1.45×1017分子/m2變化到2.30×1017分子/m2。 考慮到DMPA和DSAP都保留在界面上,單層的壓縮應減少磷脂和蛋白質的可用面積。 因此,可以估計酶的表面密度,并將其與酶活性關聯起來(圖2)。 高達12.1 ng/cm2(對應于18 mN/m的表面壓力)時,觀察到線性相關性,表明活性的增加直接反映了酶表面密度的增加。 然而,當蛋白質表面密度高于12.1 ng/cm2時,酶活性會突然下降。
圖3顯示了表面壓力對表面壓縮模量Cs-1的影響(定義49為表面壓縮性的倒數:Cs-1)[-A(?π/?A) ]T),以及DMPA朗繆爾單層中DSAP的酶活性。表面壓縮模量在圖3中是首選的,因為它隨著表面堆積而增加,并且也可以與單層的狀態相關。液體冷凝膜的Cs-1值通常高于50 mN/m。事實上,曲線中的斷點(在圖1中19(1 mN/m)處觀察到)伴隨著壓縮模量的突然增加(對于可忽略的面積/表面壓力變化,從55 mN/m到62 mN/m)此外,隨著表面壓力的增加,單層膜上的酶活性增加至均勻介質中酶活性的91%,直到18 mN/m。盡管酶活性始終低于溶液中測得的酶活性,但與表面壓力無關,最大值與先前的報告21-23,50形成對比固定在固體載體上的堿性磷酸酶的酶活性,其在均相介質中的活性范圍為10%至45%。事實上,這些研究中從未使用過低于20 mN/m的表面壓力,因為單層的高壓縮性阻礙了其向固體載體的轉移。
此外,一些研究51揭示了Na+/K+-ATP酶活性與周圍膜脂的堆積之間的強烈相關性,盡管膜組成也表現出顯著的影響。
在空氣/液體界面觀察到的DSAP的最大活性發生在18 mN/m的表面壓力下(圖3)。如表面壓縮模量Cs-1的增加所示,酶活性在該值以上突然下降,單層壓縮性也隨之下降。這一結果可以解釋圖2中觀察到的表面密度高于12.1 ng/cm2時酶活性急劇下降的原因。通過對比分析壓縮模量與表面密度相比,壓縮模量的顯著增加(與單層的表面堆積有關)成為影響酶活性的主要因素,超過18 mN/m。值得注意的是,與在35-165 mN/m范圍內觀察到的Cs-1的顯著變化無關(π在19和30 mN/m之間),酶活性幾乎保持不變,在均勻培養基中約為活性的50%。這一結果與報道的在30 mN/m表面壓力下轉移的DMPA/DSAP混合單層23 LB膜的43%活性密切相關,盡管蛋白質表面密度顯著較高(179 ng/cm2)。事實上,在相同表面壓力下,表面密度的增加導致酶活性顯著降低,這表明GPI錨定酶的活性不僅取決于蛋白質表面密度,還取決于混合單層或分子表面堆積的可壓縮性。
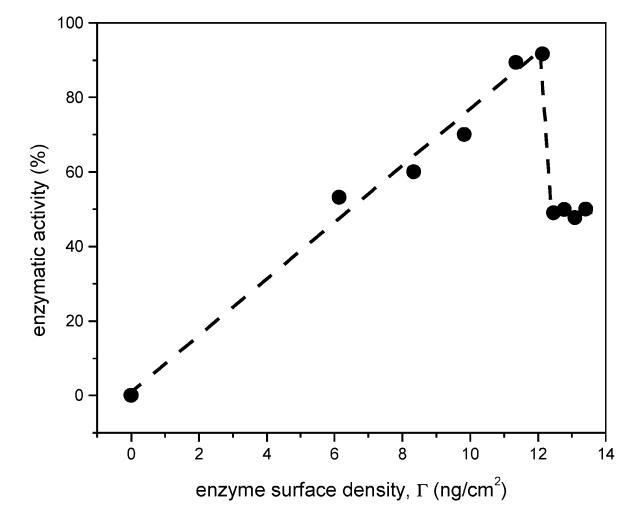
圖2.估計酶表面密度的影響(Γ)關于PNPPA酶活性。酶活性表示為在均勻介質中測得的酶活性的百分比。最大值對應于12.1 ng/cm2的酶表面密度。0-12 ng/cm2的范圍對應于0-18 mN/m的表面壓力;但是,觀察到,在圖中所示的最高表面密度中,曲線不是t線性。圖3更好地分析了對表面壓力的依賴性。
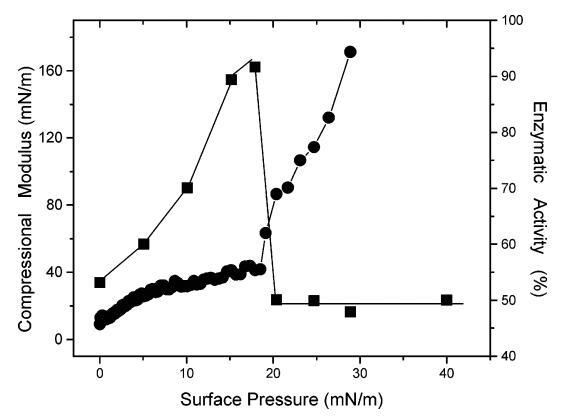
圖3.(9)在幾種表面壓力下,DSAP/DMPA(1:3500,mol:mol)混合單分子膜中DSAP的PNPPA酶活性。(b)DSAP/DMPA混合單分子膜的壓縮模量。酶活性表示為均相介質中估計值的百分比。
綜上所述,酶活性降低超過18 mN/m(每平方厘米12納克DSAP)與混合單分子層的液體凝聚相的實現相一致。因此,酶通過其錨插入的基質包裝條件的變化可能會對蛋白質的柔韌性產生深遠的影響,這是其功能活性的必要條件,盡管多肽部分之間的距離tive站點位于,并且接口。
然而,表面壓力和催化活性數據不能提供表面堆積如何影響酶/脂質混合單層形態的信息。
熒光顯微鏡。熒光顯微鏡是一種通過熒光探針在薄膜中的分布來顯示氣液界面形貌的有趣方法。當使用脂質探針時,對比度取決于它們在血液層的濃縮和膨脹相中的相對溶解度,而使用熒光標記的酶可以識別富含蛋白質的區域。圖4顯示了使用約1 mol%用熒光素標記的DSAP獲得的DMPA/DSAP混合單層的熒光顯微照片。在0 mN/m表面壓力下,在明亮的連續場上觀察到黑斑。在這種表面壓力下,純DMPA單分子膜中不存在這些結構域,這些結構域應該對應于在混合單分子膜上發生的某種分離,這種分離是由蛋白質的存在引起的。隨著表面壓力的增加,可以觀察到一些這樣的區域聚集成分形圖案。從FM顯微照片中獲得的最重要的發現是DMPA/DSAP單分子膜中存在不均勻疇,隨著表面壓力的增加,這些疇變得更亮。在較高的表面壓力下,可能會看到具有三種不同光強度模式的區域。較亮的區域對應于富含蛋白質的區域,而較暗的區域應對應于蛋白質貧乏的區域,因為在考慮標記比率時,熒光素標簽之間的熒光猝滅是極不可能的。在高于18 mN/m的表面壓力下觀察到的強亮度對應于混合單層壓縮模量突然增加的范圍(見圖3)。

圖4.DSAP/DMPA單分子膜(1:3500,mol:mol)在幾種表面壓力下的熒光顯微照片。
高達18 mN/m時,分形圖案與單個暗疇共存。在20 mN/m時,暗域不再是離散的,但發生了滲流機制,導致明亮的富含蛋白質的域最終分離。這幅圖可以歸因于富含蛋白質的相被貧蛋白質相包圍,呈分形滲流結構分布。這與其他顯示GPI錨定蛋白在液相有序相中被劃分的報告一致。27
據報道,GPI錨定的蛋白質在脂質界面形成(或誘導形成)聚集體。6,8,27,30-34,52在生物膜模型如雙層膜、脂質體、單層膜和Langmuir-Blodgett膜中也觀察到了這些簇。27,24,34,這些簇群是否是GPA介導蛋白質結構或脂質組成的結果尚待闡明。17,32 FM研究的結果(圖4)表明DMPA/DSAP混合單分子膜中存在相分離以及脂質和蛋白質聚集體。
提出了將表面密度和表面堆積與催化活性關聯的模型。提出了一個通過脂質表面堆積和氣液界面酶表面密度調節DSAP方向和催化活性的模型(圖5)。堿性磷酸酶的催化位點可能位于GPI錨的另一側。1,53在本研究所用的系統中,疏水錨應位于與DMPA酰基相互作用的空氣/水界面,而催化位點必須朝向亞相,其中基材PNPP溶解。在低表面壓力下(圖5A),催化活性主要取決于蛋白質表面密度。考慮到表面壓縮定義了平均酶表面密度(圖2),當表面壓力上升到18 mN/m時,界面中的疏水錨定排列可能有利于多肽部分向亞相調整(圖5B)。這將允許PNPP在擴散控制過程中進入酶的催化部位,從而提高酶的活性,達到均相培養基中獲得的活性的91%(圖3)。盡管增加了酶的估計平均表面密度(圖2),但混合單層的進一步壓縮會導致催化活性的突然降低,與單層壓縮性的顯著降低(圖3)和蛋白質簇的形成(圖4)相關,這可能會影響底物對催化部位的可達性(圖5C)。該模型解釋了在30 mN/m條件下轉移的DSAP/DMPA混合LB膜23之前獲得的催化活性極限值約為43%。
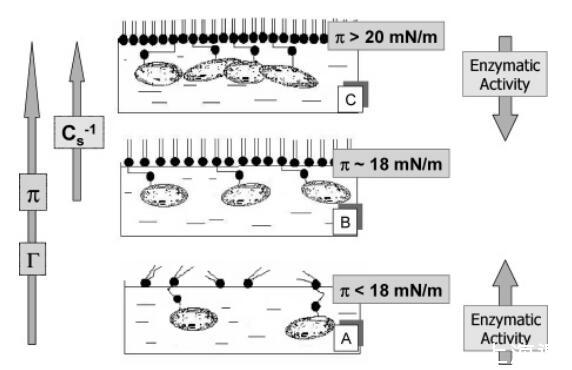
圖5. 在(A)以下、(C)以上和(B)值的表面壓力下,酶/磷脂混合單層的DSAP取向示意圖模型,觀察到單層表面壓縮模量的突然增加。 橫向箭頭表示表面壓力(π)、估計的酶表面密度(Γ)和壓縮模量(Cs-1)的增加方向。
分子表面包裝對于磷脂單分子層膜中的錨定蛋白中酶活性的調制作用的影響——摘要、介紹
分子表面包裝對于磷脂單分子層膜中的錨定蛋白中酶活性的調制作用的影響——材料和方法
分子表面包裝對于磷脂單分子層膜中的錨定蛋白中酶活性的調制作用的影響——結果和討論
分子表面包裝對于磷脂單分子層膜中的錨定蛋白中酶活性的調制作用的影響——結論、致謝!










