合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
LB膜分析儀-PPI多聚磷酸肌醇磷脂的應用(下)
來源:上海謂載 瀏覽 712 次 發布時間:2022-06-27
結果
純天然PIP2的相行為。通過將PIP2單分子膜從250?2/分子壓縮至50?2/分子,并觀察壓縮對界面表面壓力的影響,研究了純天然衍生PIP2的表面壓力(π)與分子面積之間的關系。10個單獨試驗的平均等溫線如圖1a所示。正如純PIP2酰基鏈的已知組成所預期的那樣(~50%不飽和,33%花生四烯酸),隨著分子面積的減小,這些等溫線顯示出表面壓力平滑、單調的增加。在這些實驗中使用的任何條件下,均未觀察到PIP2單分子膜的相變。與生理條件相對應的表面壓力下PIP2的平均面積(~30 mN/m 27)為73.1(3.0?2/分子,略大于SAPC(65?2)的公布值,28這是根據糖頭基的添加體積和靜電排斥預期的。盡管在生理pH下PIP2頭基的大小和相對較高的電荷密度,但該分子很容易形成緊密壓縮的單分子膜,而不是在較高的表面壓力下坍塌成水膠束結構。在所有條件下,由于屏障泄漏或單層崩塌導致的脂質損失導致的單層遲滯可以忽略不計,類似于SOPC等對照脂質(數據未顯示)。
離子強度增加對PIP2單分子膜的擴展效應。為了研究離子強度對PIP2單分子膜行為的影響,在亞相不同濃度的NaCl下取了π-A等溫線。在高于5 mN/m的所有表面壓力下,添加NaCl可顯著擴展單分子膜(圖1a)。在預先形成的PIP2單層的亞相中加入NaCl時也觀察到了這種反應。在恒定分子面積下,添加250 mM NaCl后,表面壓力增加,其大小與等溫線實驗中觀察到的大小相當,在擴散限制時間尺度上(圖1a插圖)。在π)30 mN/m時,每個PIP2分子的面積增加了13%,達到82.5?2/分子(圖1b)。該效應的劑量反應量化表明,該效應在約200 mM NaCl下飽和,并在生理相關鹽濃度范圍內顯示出顯著變化(圖1c)。
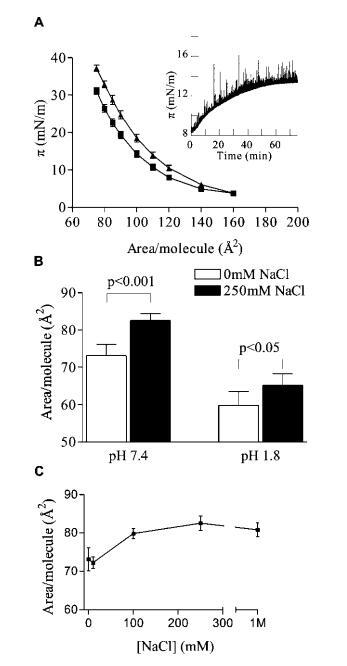
圖1:。NaCl對PIP2單分子膜的擴張效應。(A)π-含0 mM(9)和250 mM NaCl(2)的等溫線;(插圖)亞相注入250 mM NaCl(時間)0時,恒定面積/分子的表面壓力變化。(B)在pH 1.8(n)7)和pH 7.4(n)5)條件下,30 mN/m的每個分子的面積。(C)對亞相NaCl的劑量反應。誤差條為平均值(n處為SE)5,除非另有說明。所有數據均為HEPES緩沖亞相的L-R PIP2,pH 7.4(除非另有說明),30°C。
為了測試靜電機制(如反離子云排斥)導致單層膨脹的可能性,使用與PIP2實驗相同的條件,測量了250 mM NaCl對另一種帶電脂質L-R PS的影響。PS的單分子膜與PIP2的單分子膜沒有受到相同的影響,相反,隨著亞相離子強度的增加,PS的單分子膜表現出非常輕微的收縮(圖2a)。
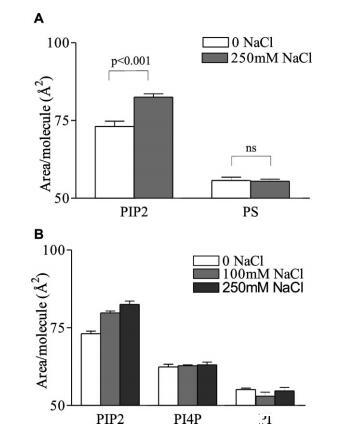
圖2:。鹽膨脹效應對PIP2的特異性。(A)L-R PIP2和L-R PS的每分子面積;和(B)HEPES緩沖亞相上的L-R PIP2、L-R PI(4)P和L-R PI,pH 7.4,π)30mN/m下的30°C。平均值(SE,n)4。
為了確定PIP2特異性膨脹是否主要由大塊肌醇環引起,同時控制酰基鏈組成,用磷脂酰肌醇4-磷酸(LR PI(4)P)和磷脂酰肌醇(LR PI)重復壓力面積等溫線。由于這些分子是細胞中酶促PIP2生成的前體,它們的脂肪酸組成與PIP2相似或相同,只是在肌醇環上的磷酸取代程度不同。與PIP2一樣,兩種肌醇基脂質均未觀察到相變,平均分子面積隨著磷酸取代度的增加而增加,與之前的觀察結果一致。29然而,盡管單磷酸鹽PI(4)P與二磷酸鹽PIP2表現出相同的趨勢,但PI和PI(4)P均未表現出對NaCl濃度增加的顯著擴張,表明類似但小得多的影響(圖2b)。這些數據表明,NaCl誘導PIP2單分子膜擴張的機制與其他陰離子以及其他肌醇基脂質相比,是PIP2特有的。
與其他陰離子磷脂相比,除了NaCl對PIP2的擴張效應具有特異性外,該效應還依賴于PIP2異構體。對肌醇環(3和5、4和5、3和4)上不同位置被取代的合成PIP2類似物的分子面積進行量化表明,分子面積不僅取決于磷酸鹽的位置,而且NaCl誘導膨脹的大小也受磷酸單酯在三種不同異構體中的位置的影響(圖5a)。對這種膨脹的直接比較表明,對于PI(3,5)P2,0和250 mM NaCl之間的差異最大(~22?),然后是PI(4,5)P2(11?2)和PI(3,4)P2(5?2),并且PIP2異構體之間的差異在統計學上非常顯著(p<0.001)。
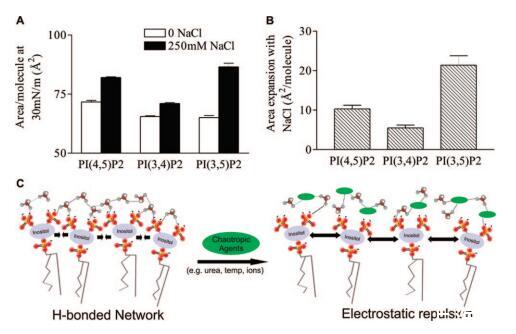
圖5:。亞相氯化鈉膨脹效應的PIP2異構體特異性。(A)HEPES緩沖亞相上的DO-PIP2異構體在π)30 mN/m時的每分子面積。平均值(SE,n)7。(B)250 mM NaCl和無亞相NaCl之間DOPIP2異構體的每分子面積差異。通過雙向ANOVA測量,NaCl效應的異構體依賴性顯著達到p)0.0001。(C)PIP2分子間相互作用的概念動畫。在沒有潮向性試劑(綠色橢圓)的情況下,PIP2分子形成水介導的氫鍵網絡。當添加潮向性聚合物時,網絡被破壞,帶電磷酸鹽之間的靜電排斥導致單層的膨脹。
不同反離子的影響。為了確定單價鹽對PIP2單分子膜的擴張效應的離子特異性,測試了其他陽離子反離子的效應。在250 mM時,所有測試的單價陽離子(Na+、K+、Li+、Cs+)顯示出類似的、統計上顯著的PIP2單分子膜擴展,其影響程度與離子的電荷密度直接相關,即Li+>Na+>K+≈Cs+(圖3a,p)0.15-0.3,因為數據集有限,離子之間的差異)。這里觀察到的電荷密度依賴性不同于鹽誘導的低電荷陰離子磷脂單分子膜的膨脹,在鹽誘導下,沒有觀察到陽離子依賴性或相反的趨勢。30與PG相比,不同陽離子引起的PIP2膨脹的幅度30似乎與描述離子潮向性的Hofmeister級數直接相關(參考文獻31)。這一結果表明,除了對頭基質子化產生影響外,這些離子還可能破壞單分子層內多分子水介導氫鍵網絡的結構。
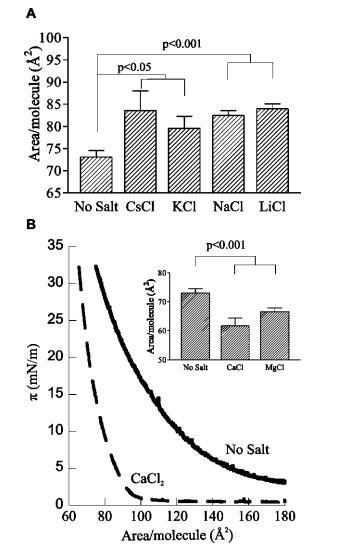
圖3:。各種反離子的影響。(A)用250 mM鹽緩沖HEPES亞相上的L-R PIP2在π)30 mN/m處的每分子面積;平均值(SE,n)5。(B)π-L-R PIP2 HEPES緩沖亞相的面積等溫線,pH 7.4,30°C(實線),相同條件加250 mM CaCl2(虛線);(插圖)250 mM CaCl2和MgCl2影響的量化;平均值(SE,n)4。
與單價鹽相比,二價反離子對PIP2的影響非常不同。CaCl2和MgCl2對純PIP2單分子膜都有很大的冷凝作用(圖3b)。圖3b中的代表性等溫線突出了這些差異,包括π)30 mN/m和較低表面壓力下每PIP2的面積。插圖顯示了二價陽離子凝聚效應的量化,并表明含有250 mM Ca2+和Mg2+的PIP2單分子膜分別比對照壓縮了15%和9%。這些結果與已知的Ca2+作為PIP2交聯劑的能力一致,Ca2+以高親和力結合和脫水多種磷酸鹽,32,33中和其電荷,橋聯頭基以形成緊密凝聚的單分子膜,34即使在低表面壓力下也是如此。
非離子液晶和溫度的膨脹效應。為了驗證單價鹽破壞PIP2頭基之間有吸引力的氫鍵相互作用的假設,部分克服了高頭基電荷密度預期的靜電排斥作用,測試了幾種非離子超嗜性因子破壞這些假定網絡和誘導單層膨脹的能力。尿素是一種因其潮向性而常用的蛋白質變性劑,海藻糖是一種非還原性葡萄糖二聚體,因其破壞水結構的能力而具有低溫保護特性,對其對PIP2單層的影響進行了測試。與通過氫鍵的吸引相互作用相一致,兩種非離子超取向對單分子膜都有很強的膨脹效應。在π)30 mN/m時,5 m尿素使每個PIP2分子的面積增加了近25%,達到90.9?2/分子,這是在這些實驗中所采用的任何條件下觀察到的最高值(圖4b)。同樣,5 mM海藻糖顯著增加PIP2單層的面積9%。這些作用對PIP2有特異性,因為兩種處理對PI的單層都沒有顯著影響。
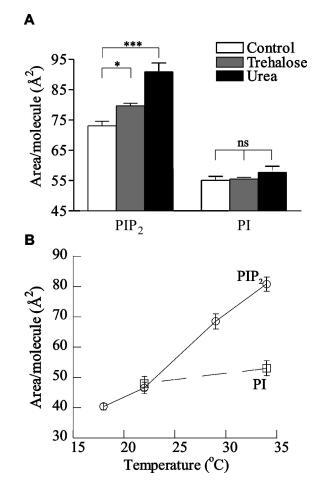
圖4:。水介導分子間氫鍵的證據。HEPES緩沖亞相上的L-R PIP2和L-R PI在π)30 mN/m時的每分子面積,pH 7.4(A)存在5 mM海藻糖和5 m尿素,(B)作為亞相(O)PIP2溫度的函數;0)PI)。
最后,為了驗證氫鍵假設,對PIP2單分子膜的溫度依賴性行為進行了測試。隨著亞相溫度從34°C降至17°C,這些單層顯示出非常顯著的收縮,每個分子的面積減少了近50%(圖4a)。相反,PI的單層僅收縮~在相同溫度范圍內為10%,與kBT壓力的簡單縮放一致。雖然由于脂質動能的降低,預計會出現一些收縮,但PIP2的50%差異強烈表明了另一種機制,如子相的熱能增加會破壞氫鍵網絡。純PIP2在亞相溫度以下不能形成壓縮單分子膜~15°C,相反,在相對較低的表面壓力下(小于10 mN/m;數據未顯示)出現坍塌。這一結果可能與理解溫度誘導的細胞結構變化有關,例如血小板的冷激活,在此過程中,質膜上PIP2組織的變化觸發肌動蛋白組裝。35 PIP2在低溫下無法保持平面狀態也可能與在4°C下溶解的細胞膜耐去污劑部分中存在PIP2有關,14通常與脂筏有關。因此,從低于15°C的結果中無法推斷在較高溫度下富含膽固醇的結構域中存在PIP2。
討論
多磷酸肌醇是一種重要的信號中間產物,但人們對產生或降解這些脂質的酶的遺傳調節和表達的了解要比決定這些脂質在質膜內分布或在不同細胞間轉運的物理化學的了解多得多。由于它們帶有很大的負電荷,人們似乎普遍認為,這些脂質在雙層平面內僅表現出相互排斥的相互作用,除非它們與特定的蛋白質絡合,否則會使它們分散。20,23,36一些證據表明,PPI在產生洗滌劑不溶性脂質組分的條件下被強烈隔離(通常被視為PPI定位于脂筏的證據14),而使用熒光能量轉移方法的研究提供了氫鍵可能穩定富含PPI的簇合物的證據。24,25在這種情況下,目前的結果提供了PPI之間靜電相互作用大小的定量估計,并表明由氫鍵介導的吸引相互作用顯著抵消了靜電排斥。
用純靜電機制很好地解釋了PIP2的壓力-面積等溫線的一個特征是單價離子對表面壓力的一般影響。盡管單價鹽在PIP2單分子膜亞相中的膨脹效應可能與頭基之間的靜電排斥作用不一致(亞相離子可能會屏蔽陰離子頭基,并允許更緊密的填充37,38),但亞相陽離子導致的單分子膜膨脹是由于磷酸單酯電離電位對離子強度的依賴性,先前顯示磷脂酸單層。39這種效應在調節荷電單分子膜的凝膠-液體轉變溫度方面很重要,40盡管亞相鹽與其他陰離子脂質的膨脹效應測量值遠小于此處觀察到的PIP2膨脹效應。30
最近,通過將系統建模為可電離基團的均勻分布平面,確定了純靜電對PIP2單分子膜表面壓力的貢獻,其電荷密度是可電離基團pKa和亞相溶液離子強度的函數。41通過區分熱力學勢與表面積的關系計算出的靜電排斥引起的表面壓力與一些觀察到的實驗結果定性一致。在中性pH下觀察到的膨脹單分子膜(高達150?2/分子)的高壓可以用高電荷頭基的排斥作用來解釋。此外,中性pH下的靜電模型證實了具有低離子強度和高離子強度的等溫線之間的交叉以及由于高離子強度導致的單層膨脹(參考文獻41中的圖1a和圖4b)。然而,許多實驗觀察到的結果與純靜電處理不兼容。具體而言,不同單價離子的不同影響不能完全通過亞相離子強度的變化來解釋。NaCl誘導的單層擴張的PIP2異構體特異性以及不帶電的潮向性和溫度的影響也表明了比表觀頭基pKa的嚴格靜電亞相離子強度調制更復雜的分子機制。此外,pH值為1.8時亞相鹽的膨脹效應(圖1b)與預測在所有磷酸單酯質子化的條件下沒有靜電效應的模型不一致(參考文獻41中的圖4f)。最后,在幾乎所有情況下,實驗測定的PIP2表面壓力明顯低于純靜電效應保守估計的預測值。
上述實驗結果突出了吸引力相互作用的重要性,這種相互作用可能是由氫鍵介導的,可以顯著對抗平面系統中PIP2脂質之間的排斥靜電相互作用。這些有吸引力的相互作用可能會被一些朝潮性因素破壞,如單價離子、海藻糖或尿素。這些發現總結在圖5c所示的定性模型中。在沒有干擾劑的情況下,幾個PIP2分子通過水介導的氫鍵網絡相互作用。當存在破壞水-PIP2相互作用的離子因素或非離子超取向物時,氫鍵被破壞,靜電排斥導致分子面積增加。該模型得到了單價陽離子對純PIP2單分子膜擴展效應的大小以及尿素和海藻糖(強非離子向潮性)的影響的支持。建議的氫鍵狀態和超臨界膨脹狀態之間的計算能量差(對于250 mM LiCl:?面積)17.8?2/分子(35 mN/m時)~6 kJ/mol)與每個PIP2分子約一個氫鍵的損失相當。這種能量與PIP2和MARCKS之間的多價相互作用能具有相同的尺度(~16千焦/摩爾)。23混合脂質系統中PIP2頭基之間存在分子間氫鍵的可能性已在實驗24,25和模擬42中得到證實,本文提供的數據通過實驗證實了這種可能性,實驗表明氫鍵是PIP2分子間相互作用的一個重要因素。
溫度對PIP2單分子膜的影響也表明這些脂質之間存在重要的非靜電相互作用。隨著溫度的降低,表面壓力的顯著下降遠遠大于其他帶電液相脂質的下降,并且不簡單地與熱能成比例。事實上,純PIP2單分子膜在室溫下的穩定性明顯低于37°C,并且不能在15°C以下形成。PIP2單分子膜在低溫下的崩塌可能與假設的PPI在低溫下聚集有關,被認為會觸發血小板的冷激活和可能的其他生物功能。35
對于觀察到的亞相鹽效應,靜電學和氫鍵的另一種解釋是,單價鹽嵌入陰離子頭基平面,在磷酸鹽和陽離子之間形成網絡晶格。這一解釋似乎不太可能,因為膨脹最大的是最小、最正電的離子(Li+),而隨著離子半徑的增大而減小(圖3a)。此外,盡管在沒有鹽的情況下形成波紋相可以產生更壓縮的單層,但沒有通過任何等溫線觀察到從液相到波紋相的相變(圖1a)。此外,波紋相僅可能在高表面壓力下形成,而在低至5 mN/m的壓力下,高鹽和低鹽狀態之間的差異很明顯(圖1a)。
有兩條證據表明水在維持這種網絡中的重要性,而不是相鄰PIP2分子之間的直接氫鍵。預計不會與磷酸基團相互作用的非離子溶質尿素和海藻糖對PIP2單分子膜具有強烈的擴張效應,這可能是由于它們破壞了水結構并隨后干擾了氫鍵網絡(圖4a)。其次,二價陽離子(Ca2+和Mg2+)誘導的PIP2每個分子面積的顯著減少證實了它們能夠橋接相鄰脂質,從而導致界面脫水,并表明盡管PIP2單分子膜通過氫鍵能力保持壓縮狀態,它們不像被二價陽離子直接交聯時那樣被緊密壓縮(圖3b)。
許多實驗表明,PIP2的許多細胞結合伙伴至少有兩種不同的相互作用模式。一些蛋白質(例如,含有PH結構域的蛋白質)對單個PIP2分子有一個特定的結合位點,43–45,而其他蛋白質則含有非結構化的多元酸結構域,被認為可以通過非特異性靜電吸引同時結合多個PIP2分子(例如,MARCKS23,46)。考慮到細胞可能通過影響氫鍵和靜電排斥之間的平衡來調節PIP2介導的信號傳導,從而調節可用于單個脂質結合蛋白域的PIP2池與可用于結合多分子組裝的PIP2池,這似乎是合理的。
確認。這項工作得到了MRSEC第05-20020號贈款(I.L.和P.A.J.)和富布賴特基金會(A.C.)的資助。










