合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
應用不同組裝的磷脂酰膽堿對牛精漿蛋白的隔離——材料與方法
來源:上海謂載 瀏覽 1030 次 發布時間:2021-10-20
二、材料與方法
2.1. 材料
主要構成重建膜外葉的脂質購自 Avanti Polar Lipids (Alabaster, AL, USA) 并按原樣使用。 化合物 1- 棕櫚酰-2-二十二碳六烯酰-sn-甘油-3-磷酸膽堿 (PC (16:0/22:6), Mw = 806.1, 純度 > 99%) 和 1-(1Z-十八碳烯基)-2- 二十二碳六烯酰-sn-甘油-3-磷酸膽堿 PC (P-18:0/22:6, Mw = 818.2,純度 > 99%) 作為氯仿溶液 (10 mg mL-1) 獲得。 PC (16:0/22:6) 和 將 P-PC (18:0/22:6) 稀釋以獲得 1.25 mg mL-1 溶液。 來自綿羊毛的膽固醇(Chol,Mw = 711.0,純度 > 98%)和 來自雞蛋的鞘磷脂(SM,Mw = 386.7,純度 > 98%) 以粉末形式獲得。 兩者都溶于氯仿 (HPLC 級,Carlo Erba,Val de Reuil,法國)濃度為 1.25 毫克毫升-1。
冷凍保護培養基由 Trizma 堿組成 (173.0 mM),檸檬酸一水合物 (70.0 mM),果糖 (56.0 mM)、甘油 (6.4%; v/v),最后是抗生素(青霉素 G 鈉 391 mg L?1,硫酸鏈霉素 856 mg L?1,林可霉素 鹽酸鹽 204 mg L?1,硫酸壯觀霉素四水合物 585 mg L-1)(Sigma-Aldrich,St. Quentin Fallavier,法國)。 這 pH 值調整為 6.2,其滲透壓約為 1300.0 摩爾滲透壓。
2.2. 低密度脂蛋白的提取
從蛋黃中提取低密度脂蛋白 (LDL) 根據穆薩等人的協議。 [31]。 提取后,LDLs 的濃縮提取物(22 ± 0.5 g 相當于 8.36 g 干 LDL)在冷凍保護培養基中稀釋 (100 毫升)。 低密度脂蛋白樣品中蛋白質的定量 微 BCA 蛋白質測定試劑盒(Pierce,Thermoscientific,法國)提供 8.9 ± 1.0 毫克毫升-1。 低密度脂蛋白樣品中 PC 磷脂的含量 由雞蛋中 PC 的自然比例計算得出(18.4 g PC/100 g ofdry LDLs) 由 Antonet al. [33] 給出。它等于 15.4 g L?1 LDLs 樣本。 低密度脂蛋白還包含一小部分 PE (PC/PE 6:1) [33]。
2.3. 收集血漿精液
牛精子是從一頭 Prim Holstein 公牛身上收集的,并且 立即以 10,000 × g 離心兩次以回收精液 上清液中的血漿。 我們樣品的蛋白質含量 是 88.5 ± 5.0 mg mL-1,由微 BCA 蛋白確定 檢測試劑盒(Pierce,Thermoscientific,法國)。
2.4. 脂質體的制備
脂質體由卵磷脂的提取物制成 使用迷你擠出機通過擠出在冷凍保護緩沖液中 來自 Avanti Polar Lipids (Alabaster, Alabama, USA)。 的提取物 卵磷脂由磷脂酰膽堿 (73%) 和 磷脂酰乙醇胺 (11%) 和少量成分,包括甘油三酯和鞘磷脂。 提取物在 冷凍保護緩沖液在脂質濃度為 分別為 3.90 mg mL-1 (C1)、7.28 mg mL-1 (C2)、14.56 mg mL-1 (C3) 和 21.84 mg mL-1 (C4)。 然后對分散液進行超聲處理 在超聲波浴(來自德國辛根 Elma 的 Elmasonic S 30H,功率為 275W)中持續 15 分鐘。 最后,分散是 在擠出機中擠出(20 次通過 100 nm 膜)。 分布尺寸以 120 nm 為中心,Zeta 電位 值為 -6 mV。 在 BSP 存在下引入的脂質體量以重量表示(1.17 mg、2.18 mg、4.37 mg 和 6.55 mg 脂質,用于脂質體分散體 C1、C2、C3 和 C4 分別)。 不確定度為 0.01 毫克。
2.5. 電泳
十二烷基硫酸鈉聚丙烯酰胺凝膠電泳 (SDS-PAGE) 在還原條件下進行。 開創性的 將血漿溶解在由 Tris 0.5 M 組成的 pH 6.8 緩沖液中, SDS 10%、甘油 30% w/w 和溴酚藍 0.4% 得到 1 mg mL-1 溶液。 9% 巰基乙醇 v/v 是 加入樣品,渦旋混合,隨后加熱至 95°C 5 分鐘。 那么,10 ? L 低范圍分子量 標準(來自 Euromedex、Souffelweyersheim、 法國) 和 10 到 25 ? L 精漿裝載在 15%- 聚丙烯酰胺凝膠(pH 6.8-Tris 0.5 M 和 SDS 0.10%)偶聯 使用由 Tris 0.025 M、甘氨酸組成的 pH 8.3 遷移緩沖液 0.192 M,SDS 0.1%。 電泳在 20 mA 下進行, 凝膠用考馬斯藍 G250 溶液染色。 染色的 最后掃描凝膠并評估峰的強度 通過 Multi Gauge 軟件(2.0 版,Fuji Photo Film Co., Ltd., 日本)。
2.6. 表面活性測量
測量吉布斯膜(通過從精漿溶液擴散到空氣-緩沖液界面而形成)的表面張力 在 15 孔板(鋁底多孔板,帶有 Teflon 輪輞)安裝在朗繆爾天平(微槽 XL-LB,Kibron Inc., Helsinki, Finland)配備高靈敏度傳感器(使用合金線的威廉米法)。 該設備被放置在一個 溫度控制區域固定在 23°C,并用純蒸餾水校準(Milli-Q 系統,Millipore,美國)。 測量精度為 0.1 mN/m。 精漿被放置在 第一個孔然后在下一個孔中稀釋 2 倍,依此類推(每個 井的體積為 300 ? L)。 重復測量 每種精漿提取物 4 次 (n = 2)。 結果是 表示為所有測量值的平均值。
在配備傳感器的先前朗繆爾槽上測量蛋白質膜的壓縮等溫線 (微槽 XL-LB,Kibron Inc.,赫爾辛基,芬蘭)。 開創性的 血漿首先在冷凍保存的緩沖液中稀釋(1/100) 并在緩沖液表面逐滴(50 升)展開。 這 在平衡 20 分鐘后和在室溫 (23°C) 下記錄壓縮等溫線。
2.7. 外葉脂質結構域的重建 精子膜
精子外葉的脂質結構域 如前所述[35]重建膜。 這 Langmuir 槽 (302LL, Nima Technology, UK) 被插入一個 自制手套箱放在防震臺上并沖洗 用氬氣防止脂質氧化。 測量表面壓力 使用由過濾器制成的 Wilhelmy 板,精度為 0.1 mN/m 紙(Whatman 的無灰 Whatman 色譜紙) International Ltd., Maidstone, Kent, UK) 連接到一個電 平衡。 環境溫度固定在 20℃。 所有燒瓶 和注射器被引入手套箱,然后 在鋪展單層之前用氬氣脫氣 1 小時。 朗繆爾天平的溫度是恒溫控制的 通過設置在 40 ℃ 的循環水系統。 真實溫度 緩沖液表面的溫度為 34°C。 子階段包括 冷凍保護介質。 膽固醇、鞘磷脂、P-PC (18:0/22:6) 和 PC (16:0/22:6) 的氯仿溶液 適當的摩爾比(31:14:16:39)逐滴展開 到緩沖子階段 25 ? L 微量注射器(精確到 0.5 ? L)(Hamilton Bonaduz AG,Bonaduz,瑞士)。 在壓縮之前,讓單層平衡 10 分鐘 以 40 cm2/min 的屏障速度啟動。 一旦達到目標壓力 (25 mN/m),壓力就會保持不變 通過使用可移動障礙物調整表面積來保持恒定。 由于單層在 30 mN/m 下隨時間不夠穩定 這是與脂質堆積密度相關的薄膜壓力 雙層 [36],我們將目標壓力降低到 25 mN/m,其中 單層更穩定(見結果)。
一旦達到目標壓力 (25 mN/m), 在引入解決方案之前保持 1000 s 生物分子(低密度脂蛋白、BSP 或脂質體)進入亞相 彎針注射器。 針遠離尖端彎曲 躺在槽的底部,以便注射 在壓縮亞相之下執行。 等量的體積(每種添加劑 0.3 毫升)之前被移除 障礙。 注入生物分子后,面積變化 監測每個脂質分子并表示為變化 相對于初始值 (A/A= (A?A(t0)) × 100/A(t0))。 它有 被跟蹤了 3000 秒,時間對應于處理 冷凍保存前的精液。 在這種恒壓模式下, 生物分子插入脂質單層導致 通過增加而降低的薄膜壓力的增加 表面積。 反之,表面積減少 生物分子導致脂質單層溶解在亞相中。 重復所有數據,偏差不超過5% 的表面積。
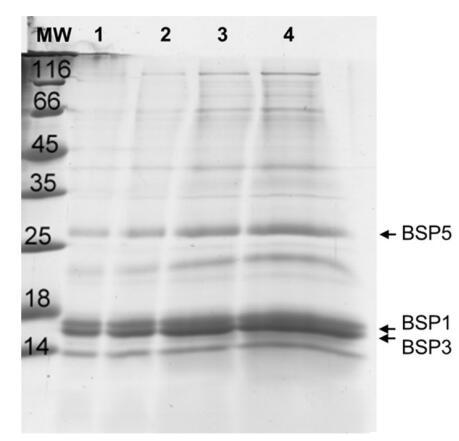
圖 1. 從牛精液中分離的精漿的 SDS-PAGE 凝膠和 以不同濃度沉積:泳道 1:1 ? G; 車道 2:2 ? G; 車道 3:5 ? g和車道 4:10? G。
2.8. 低溫透射電子顯微鏡 (cryo-TEM)
使用cryoplunge冷凍固定裝置(Gatan,USA)制備冷凍TEM觀察標本,其中一滴 將水懸浮液沉積在輝光放電的多孔型碳涂層網格(Ted Pella Inc.,美國)上。 TEM 網格是 然后通過吸干含有樣品的液滴來制備 支撐碳膜中的孔中保留有薄薄的液體層。 通過快速插入網格使液膜玻璃化 轉化為由液氮冷卻的液態乙烷。 玻璃化標本安裝在 Gatan 910 標本架(Gatan,美國) 使用 CT-3500-cryotransfer 插入顯微鏡 系統(Gatan,美國)并用液氮冷卻。 透射電鏡圖像 然后從保存在玻璃冰中的標本中獲得 懸浮在支撐碳基板上的孔中。
在低劑量條件下觀察樣品 (<10 e-/A2),-178 ℃,使用 JEM 1230 'Cryo' 顯微鏡(Jeol, Japan) 在 80 kV 下運行并配備了 LaB6 燈絲。 全部 顯微照片記錄在 Gatan 1.35K × 1.04K × 12 位 ES500W CCD 相機。 采集了 50 多張圖像系列 對于來自多個樣品制備的每個樣品,具有不同的 放大倍數,以確保觀察的良好重復性。










